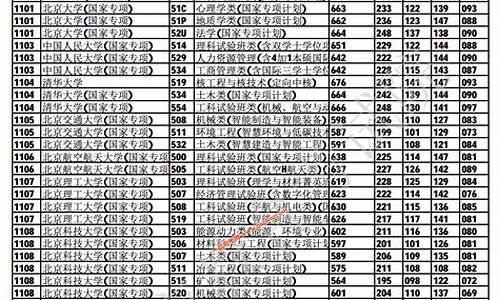
您现在的位置是: 首页 > 教育改革 教育改革
江苏2017高考化学试题-江苏2017高考化学试题及答案
tamoadmin 2024-08-28 人已围观
简介1.2017年高考是全国统一卷卷子一样吗2.2017年江西高考化学一轮模拟试题及答案3.高考化学实验题知识点总结2017年高考是全国统一卷卷子一样吗2016年高考,除北京、上海、天津、江苏、浙江五地以外,全部使用(或部分使用)全国卷的省份达到26个。2016年高考全国卷共有3套,分别是全国Ⅰ卷、全国Ⅱ卷、全国Ⅲ卷。2017年高考,各省份的试卷使用情况会发生怎样的变化呢?各省份试卷使用情况全国Ⅰ卷地
1.2017年高考是全国统一卷卷子一样吗
2.2017年江西高考化学一轮模拟试题及答案
3.高考化学实验题知识点总结
2017年高考是全国统一卷卷子一样吗

2016年高考,除北京、上海、天津、江苏、浙江五地以外,全部使用(或部分使用)全国卷的省份达到26个。2016年高考全国卷共有3套,分别是全国Ⅰ卷、全国Ⅱ卷、全国Ⅲ卷。2017年高考,各省份的试卷使用情况会发生怎样的变化呢?
各省份试卷使用情况
全国Ⅰ卷地区:
福建、河南、河北、山西、江西、湖北、湖南、广东、安徽
全国Ⅱ卷地区:
甘肃、青海、内蒙古、黑龙江、吉林、辽宁、宁夏、新疆、西藏、陕西、重庆
全国Ⅲ卷地区:
云南、广西、贵州、四川
自主命题省份:
江苏、北京、天津、上海
部分使用全国卷省份:
海南省:全国Ⅱ卷(语、数、英) 单独命题(政、史、地、
物、化、生)
山东卷:全国Ⅰ卷(外语、文综、理综) 自主命题(语文、文数、理数)
2017年考试改革地区
高考改革地区:
浙江、上海
考试模式:
3+3,不分文理科
必考科目:
语文、数学、外语,每科150分
改革后的考试具体安排如下
外语考试:
浙江每年2次,6月和10月;上海每年2次,1月和6月 。
选考科目:
浙江实行7选3,每科满分100分:思想政治、历史、地理、物理、化学、生物、信息技术(特别说明:浙江省的选考科目考试次数为2次,分别在4月和10月,外语和选考成绩2年有效。)
上海实行6选3,每科满分70分,思想政治、历史、地理、物理、化学、生命科学 。
录取方式 :
浙江
1.高考录取不分批次;
2.“专业 学校”平行志愿,按专业平行投档。
上海
1.合并本科第一、二招生批次;
2.“总分志愿”,分学校实行平行志愿投档和录取。
2017年高考除浙江、上海因实行高考改革变化较大外,全国其他地区保持稳定,考试模式仍与2016年保持一致。
前不布的2017年高考考试大纲有了新的变化,浙江和上海的小伙伴们也即将面临新的高考改革,种种变化都在表明2017高考离我们越来越近了。
如何应对2017高考全国卷?
语文
阅读选考变全考,提升答题速度是关键
阅读复习更讲求深度,着重提高读解能力;
语用和写作复习要讲求实用,着重提高书面表达能力。
从新闻、学术论文、人物传记和访谈、戏剧等作品材料中,选取更生动鲜活的事例。最重要的是考生要提高阅读速度和阅读量,同时加强对古代文化基础知识以及古诗文的积累”。
意味着语文答题时间将更加紧张。大纲调整后,高三学子在文学类阅读上可能要下更多的努力。
数学
数学全国卷最大的特色是“稳定”。
选考模块三变二,增加数学文化的要求。
在全国卷中,代数有10个小题,2个大题;立体几何有2个小题,1个大题;解析几何有2个小题,1个大题;算法有1个小题;概率统计有1个小题,1个大题。
在全国卷中,数列考查的要求低了,概率统计考查更深入了。
全国卷强调“能力立意”,所以要重视运算能力的训练,培养合理、准确的运算能力。
文综
更加强调学生跨学科的学习能力
历史的考查的趋势是“轻教材,重材料”,这对学生的知识面、学科拓展能力等都提出了新的要求,学生需要在扎实掌握主干知识的基础上进行“提效”,也就是提升自己的学科素养,而不再是死记硬背书本知识。
地理的复习,需要学生关注社会焦点和热点问题,及时收集多种媒体上的信息资料,关注世界与国家发展中出现的新情况新问题。
政治全国卷试题经常会考查到一些“冷门”考点,甚至将其作为大题来考,考生应牢记考点内容,从深度和广度两个维度掌握好每个考点,做到逐点过关。
理综
不走“题海战术”,重视自主设计新实验能力
物理全国卷试题常以生活、科技、社会、环境为背景,关注物理学发展过程中的重要史实,关注当代科学技术发展的重要成果,复习要加强理论联系实际,引导考生关注自然科学发展的最新成果及其对社会的影响。
化学大幅度地增加了实验探究活动,学生要重新走进实验室,重做典型的动手实验。
化学生物变动少,对考生影响不大。
2017年江西高考化学一轮模拟试题及答案
1.化学与生活密切相关,下列有关说法错误的是( )
AAl(OH)3是某些胃药的一种成分
B乳酸铁是某些补铁口服液的有效成分
C臭氧可以作为新型自来水消毒剂
DSO2常用作红葡萄酒中杀菌消毒剂
分值: 3分 查看题目解析 >
2
2.下列反应不能用离子方程式“H++OH-=H2O”表示的是( )
AH2SO4溶液与NaOH溶液混合
BHCl气体通人Ca(OH)2溶液中
CHNO3溶液与KOH溶液混合
DNH4HSO4溶液与NaOH溶液混合
分值: 3分 查看题目解析 >
3
3.下列叙述错误的是( )
A胶体化学可用于制备纳米材料
B钛合金主要用于尖端领域
C压电陶瓷可实现化学能与电能的转化
D稀土元素大大改善合金性能被称为冶金工业的维生素
分值: 3分 查看题目解析 >
4
4. 下列有关实验操作的叙述错误的是( )
A过滤操作中,玻璃棒应适时搅拌漏斗器
B蒸发时,不能把蒸发皿放置于石棉网上加热
C萃取分液时,将塞上凹槽或小孔对准漏斗上小孔,然后打开活塞才能放出下层液体
D配制容量瓶,定容时改用胶头滴管滴加蒸馏水
分值: 3分 查看题目解析 >
5
5.能证明Fe(NO3)3中铁元素具有氧化性的实验事实是( )
A通人H2S,有**沉淀
B加入铜粉,溶液变为蓝色
C加人锌粉,溶液棕**逐渐消失
D滴加NaHCO3溶液,有气体和红棕色沉淀生成
分值: 3分 查看题目解析 >
6
6. 一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中·和○代表不同元素的原子。关于此反应判断错误的是( )
A可能是双氧水分解反应
B充分反应后,还有物质,则属于可逆反应
C反应前后,一定是共价键的断裂与生成
D反应方程式可表示为:
分值: 3分 查看题目解析 >
7
7.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A28gMgCO3和NaHCO3混合固体中的CO32-离子数为NA
BlmolI2与4molH2反应生成的HI分子数为2NA
C1molAl溶于含1molNaOH溶液,电子转移数为3NA
D标准状况下,2.24LH2O含有的共价键数为0.2NA
分值: 3分 查看题目解析 >
8
8.下列实验操作能达到实验目的的是( )
A
B
C
D
分值: 3分 查看题目解析 >
9
9.下列有关物质的性质与用途具有对应关系的是( )
ASiO2熔点高,可用作光导纤维
BLi还原性强且质轻,常用作负极材料
CFe2(SO4)3具有氧化性,能用作净水剂
DSO2能杀菌,可用于漂白纸浆
分值: 3分 查看题目解析 >
10
10.向含有Cu2(OH)2CO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变大的是( )①c(CO32-)②c(Cu2+)③c(Cl-)④c(OH-)⑤c(H+)
A②③⑤B①③⑤C③④⑤D①②④
分值: 3分 查看题目解析 >
11
11.下列对物质或离子的检验,结论正确的是( )
A加入KSCN溶液,溶液变红,证明原溶液含有Fe3+
B将气体通入KMnO4酸性溶液,紫色褪色,证明气体为乙烯
C将气体通入澄清石灰水,有白色沉淀,证明气体为CO2
D加入BaCl2溶液,沉淀不溶于盐酸,证明原溶液含有SO42-
分值: 3分 查看题目解析 >
12
12.如图,缓慢通入O2,用水吸收NO2(设每次通入的O2能完全反应)。下列说法正确的是( )
A当试管内溶液的pH值不再变化,说明NO2全部转化为HNO3
B当试管气体不是红棕色时,说明NO2全部转化为HNO3
C水槽内的水改为稀盐酸,有利于吸收NO2
D水槽内的水改为稀NaOH溶液,有利于吸收NO2
分值: 3分 查看题目解析 >
13
13.有反应:3C+SiO2SiC+2CO,下列说法正确的是( )
ASiC是氧化产物
B还原剂与氧化剂的物质的量之比为1:2
C若生成4.48LCO,则转移0.4 mol 电子
DC 既是氧化剂又是还原剂
分值: 3分 查看题目解析 >
14
14. 0.1molCu、0.lmolH2SO4、0.1lmolHNO3混合共1L,充分反应,下列预测正确的是( )
A铜全部溶解,且溶液为蓝色,有红棕色气体产生
B铜部分溶解,且溶液为蓝色,有红棕色气体产生
C铜全部溶解,且溶液为蓝色,有无色气体产生
D铜部分溶解,且溶液为蓝色,有无色气体产生
分值: 3分 查看题目解析 >
15
15.实验室从含氯化钠、硝酸钾混合液中提取KNO3的过程如下图所示。下列分析正确的是( )
A
B
C
D
分值: 3分 查看题目解析 >
简答题(综合题) 本大题共55分。简答应写出文字说明、证明过程或演算步骤。
16
含同一元素的常见物质A、B、C,有如下转化关系(条件未标注):
16.当甲是KOH时,白色沉淀B为_________。
17.当甲为H2O时,气体B为__________。
18.当A为Na时,单质甲为____________。
19.当A为NH3时,气体单质B为___________。
分值: 7分 查看题目解析 >
17
下面是工业利用铝土矿(含杂质SiO2、Fe2O3)制取铝的工艺流程,回答有关问题:
20.铝土矿磨碎化浆,利用胶体粒子的性质,通入直流电除去_____,制得50%铝土矿。
21.操作I的名称是______,实验室进行此操作所需玻璃仪器为________。
22.加入NaOH所发生的离子反应方程式为_________,滤渣一为_______(填化学式)。
23.电解槽用石墨作阳极,生成二氧化碳的原因是__________。
分值: 9分 查看题目解析 >
18
处理生活污水中的NH4+,过程如下:
24.空气将NH4+转变为NO3-或NO2-,溶液pH__________(填“增大”、“减小”或 “不变”)。
25.根据较新的研究表明,将只含NO2-的污水与含NH4+的污水按比例混合,直接转化为无毒气体,该气体为_________。此方法的优点是__________。
26.完全处理含1mol NH4+污水,则n(O2)与n(CH3OH)关系式为_______[以n(O2)与n(CH3OH)表示]。
分值: 8分 查看题目解析 >
19
某班同学用如下实验探究Na2CO3、NaHCO3的性质。回答下列问题:
27.甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是__________。
28.乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示:
① 碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是______(填A、B、C、D或E)。
② B点的主要溶质是_________(用化学式表示)。
③ B点______(填“大于”或“小于”) D点的pH,主要原因是_____________。
29.丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式:___________________________。
分值: 11分 查看题目解析 >
20
实验是进行科学探究的主要方法。回答下列问题:
30.实验室利用A 发生装置制备的常见气体有___________。
31.检验装置B的气密性方法是______________。
32.收集一瓶纯净氯气,选择上图装置,按气流方向,用小写字母表示连接顺序_______(装置不重复使用)。实验室检验氯气的方法是__________。
33.某实验小组按顺序连接adcfeg制取并收集氨气,导致实验失败,原因是_________。
分值: 10分 查看题目解析 >
21
H2O2是绿色氧化剂,且酸性介质下有更强的氧化性;易溶于水显弱酸性,常温下K1=1×10-12,K2=1×10-25。回答下列问题:
34.常温下水的电离平衡常数K约为________,K、K1、K2从大到小顺序为________。
35.在硫酸亚铁存在条件下,H2O2溶液可以把苯(C6H6)氧化为苯酚(C6H5OH)。反应后的混合物经过______、蒸馏得到苯酚;理论上制取1mol苯酚需要消耗H2O2_______mol,实际消耗大于理论用量的主要原因是________________。
36.K4[Fe(CN)6](**溶液)、K3[Fe(CN)6](黄绿色溶液)与一定量H2O2组成的混合物,用酸或碱调节混合溶液的pH,会出现**、黄绿色交替变化。按照从酸性至碱性的顺序,可观察到的现象是______________。
37.工业用H2O2除去废水中的Cl2,氧化产物是______;与SO2除Cl2相比,其优点是________。
21 第(1)小题正确答案及相关解析
正确答案
56×10﹣14 K1>K>K2
解析
常温下水的Kw=1×10﹣14,则电离平衡的常数K约为56×10﹣14,H2O2的K1=1×10﹣12,K2=1×10﹣25,K、K1、K2从大到小顺序为K1>K>K2,
故答案为:56×10﹣14;K1>K>K2;
考查方向
化学平衡常数;水的电离平衡常数
解题思路
常温下水的电离平衡的常数K约为56×10﹣14,H2O2的K1=1×10﹣12,K2=1×10﹣25;
易错点
本题考查化学平衡常数的大小比较,掌握化学平衡常数的表示方法是解题的关键,难度不大。
21 第(2)小题正确答案及相关解析
正确答案
分液 1 苯酚不稳定易被氧化
解析
发生H2O2+C6H6C6H5OH+H2O,苯酚、苯与水分层,反应后的混合物经过分液、蒸馏得到苯酚,由反应可知,理论上制取1mol苯酚需要消耗H2O2 为1mol,实际消耗大于理论用量的主要原因是苯酚不稳定易被氧化,则消耗的过氧化氢就多,
故答案为:分液;1;苯酚不稳定易被氧化;
考查方向
物质的分离与提纯;化学计量的计算;物质的性质与用途
解题思路
发生H2O2+C6H6C6H5OH+H2O,苯酚、苯与水分层,苯酚不稳定易被氧化;
易错点
本题考查物质的分离与提纯,同时涉及到相关计算,根据物质的性质结合题意分析即可,注意基本实验操作的整理,难道不大。
21 第(3)小题正确答案及相关解析
正确答案
溶液由黄绿色变为**
解析
由2H++[Fe(CN)6]4﹣(**溶液)+H2O2?[Fe(CN)6]3﹣(黄绿色溶液)+2H2O,酸性条件下平衡正向移动,碱性条件下平衡逆向移动,则按照从酸性至碱性的顺序,可观察到的现象是溶液由黄绿色变为**,
故答案为:溶液由黄绿色变为**;
考查方向
溶液酸碱性对物质性质的影响
解题思路
由2H++[Fe(CN)6]4﹣(**溶液)+H2O2?[Fe(CN)6]3﹣(黄绿色溶液)+2H2O,酸性条件下平衡正向移动,碱性条件下平衡逆向移动;
易错点
本题考查溶液酸碱性对物质性质的影响,掌握常见物质的性质是解题的关键,注意灵活分析题目所给信息,难度不大。
21 第(4)小题正确答案及相关解析
正确答案
O2 过量除杂试剂H2O2不会排出有毒气体,且废水酸性较弱
解析
用H2O2除去废水中的Cl2,发生H2O2+Cl2=2HCl+O2可知,O元素失去电子,对应氧化产物为O2,SO2除去废水中的Cl2,发生Cl2+SO2+2H2O=H2SO4+2HCl,则与SO2除Cl2相比,其优点是过量除杂试剂H2O2不会排出有毒气体,且废水酸性较弱,
故答案为:O2;过量除杂试剂H2O2不会排出有毒气体,且废水酸性较弱。
考查方向
氧化还原反应的本质;物质的性质与用途
解题思路
结合H2O2+Cl2=2HCl+O2、Cl2+SO2+2H2O=H2SO4+2HCl分析;
易错点
本题考查物质的性质与用途,涉及氧化还原反应的相关知识,掌握基础知识结合题目回答即可,难度不大。
高考化学实验题知识点总结
高中化学实验题是化学中重要的一题,那么化学实验题该怎么做呢?下面就是我给大家带来的高考化学实验题知识点 总结 ,希望大家喜欢!
高考化学实验题知识点:文字表达归纳
1、浓硫酸的稀释:
向烧杯中加入一定量的蒸馏水,沿烧杯内壁缓慢倒入浓硫酸并不断用玻璃棒搅拌。
2、用pH试纸测定溶液酸碱性:
用干燥洁净的玻璃棒蘸取待测液点在pH试纸中部,与标准比色卡比较,读出溶液的pH。
3、用试纸检验气体:
(以NH3为例)用玻璃棒贴取湿润的红色石蕊试纸放在集气瓶口或试管口,看试纸是否变蓝。
4、检查装置的气密性(以大试管单孔塞为例):
①微热法:将导管插入水槽中,手握大试管,若导管口有气泡冒出,松开手时导管口回流一段水柱,说明该装置的气密性良好。
②液差法:塞紧橡皮塞,用止水夹夹住导气管的橡皮管部分,从长颈漏斗中向试管中注水,使长颈漏斗中液面高于试管中液面,过一段时间,液面差不变,说明气密性良好。(若为分液漏斗,塞紧橡皮塞,用止水夹夹住导气管的橡皮管部分,向分液漏斗中加入一定量的水,打开活塞,若分液漏斗中液体滴下的速率逐渐减慢至不再滴下,说明气密性良好。)
5、闻气体的气味:
用手在集气瓶口上方轻轻扇动,使少量气体飘入鼻孔。
6、焰色反应:
(以K元素为例)用洁净的铂丝蘸取待测液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察火焰是否为紫色。(注:洗涤铂丝用盐酸溶液)。
7、洗涤沉淀:
把蒸馏水沿着玻璃棒注入到过滤器中至浸没沉淀,静置,使蒸馏水滤出,重复2~3次即可。
8、判断沉淀剂是否足量的操作:
在上层清液中(或取少量上层清液置于小试管中),滴加沉淀剂,若不再产生沉淀,说明沉淀完全。如粗盐提纯实验中判断BaCl2已过量的 方法 是:在上层清液中再继续滴加BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量。
9、判断沉淀是否洗涤干净的操作:
取少量最后一次洗涤洗液,滴加相应试剂……
10、萃取分液操作:
关闭分液漏斗活塞,将混合液倒入分液漏斗中,充分振荡、静置、分层,在漏斗下面放一个小烧杯,打开分液漏斗活塞,使下层液体从下口沿烧杯壁流下;上层液体从上口倒出。
11、量气操作注意:
待温度恢复至室温时,调节量筒(或量气管)使左右液 面相 平。
12、酸碱中和滴定终点判断:
如强酸滴定强碱,用酚酞用指示剂,当最后一滴酸滴到锥形瓶中,溶液由红色变为无色,且半分钟内不变色即为终点。(拓展:氧化还原滴定如用KMnO4滴定草酸:溶液由无色变为浅紫色,且半分钟不褪色。)
13、有机实验中长导管的作用:
冷凝回流,提高反应物的利用率。
14、氢氧化铁胶体的制备:
往煮沸的蒸馏水中逐滴滴加饱和的FeCl3溶液,当溶液变红褐色时,立即停止加热。
15、渗析操作:
将胶体装到半透膜袋中,用线将半透膜扎好后系在玻璃棒上,浸在烧杯的蒸馏水中,并及时更换蒸馏水。
16、容量瓶检漏操作:
往容量瓶内加入一定量的水,塞好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围有无水漏出。如果不漏水,将瓶正立并将瓶塞旋转180度后塞紧,仍把瓶倒立过来,再检查是否漏水。如果仍不漏水,即可使用。
17、气体验满和检验操作:
①氧气验满:用带火星的木条放在集气瓶口,木条复燃,说明收集的氧气已满。②可燃性气体(如氢气)的验纯方法:用排水法收集一小试管的气体,用大拇指摁住管口移近火焰, 若听到尖锐的爆鸣声,则气体不纯;听到轻微的“噗”的一声,则气体已纯。(可燃性气体在加热或点燃之前必须检验气体纯度。)
③二氧化碳验满:将燃着的木条平放在集气瓶口,若火焰熄灭,则气体已满。④氨气验满:用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝说明气体已满。⑤氯气验满:用湿润的淀粉碘化钾试纸放在集气瓶口,若试纸变蓝说明气体已满。
18、玻璃仪器洗净的标准是:
既不聚成水滴,也不成股流下。
19、皂化反应完成的标志:
静置不分层。
20、引发铝热反应的操作:
加少量KClO3,插上镁条并将其点燃。
21、量取液体读数:
视线应与刻度和液面凹液面最低点水平相切。
22、银氨溶液的配制:
在硝酸银溶液中边摇动试管边逐滴滴加稀氨水至沉淀恰好溶解为止。
23、固体加热至恒重的标志:
连续两次称量质量差不超过0.1g。
24、淀粉水解程度的判断:
完全水解——加入碘水,不显蓝色。
尚未水解——取水解液先加NaOH溶液于试管,再加入新制的Cu(OH)2加热,若无砖红色沉淀产生,证明淀粉没有水解。
部分水解——用两个试管取两份水解液,一份加入碘水显蓝色,另一份加碱中和硫酸 后再加入
新制的Cu(OH)2加热, 产生砖红色沉淀 (同时具有上述两种现象)。
25、检验卤代烃中卤原子的操作:
取样与NaOH溶液共热,然后加HNO3酸化,再加AgNO3溶液,据沉淀颜色进行判断。
26、物质检验操作:
取样→加试剂→表现象→说结论。
高考化学实验题知识点:化学实验注意事项
1.银氨溶液、氢氧化铜悬浊液、氢硫酸等试剂不宜长期存放,应现配现用
正确,银氨溶液久制易生成Ag3N极为易爆
2.实验室制取氧气完毕后,应先取出集气瓶,再取出导管,后停止加热
正确
3.品红试纸、醋酸铅试纸、pH试纸、石蕊试纸在使用前必须先用蒸馏水润湿
错误,PH试纸不润湿
4.用标准盐酸滴定未知NaOH溶液时,所用锥形瓶不能用未知NaOH溶液润洗
正确
5.为防止挥发,浓氨水、氢氟酸、漂、液溴、汽油、乙酸乙酯等均需密封保存
错误,漂不易挥发但易变质,所以需要密封保存
6.浓H2SO4沾到皮肤上,应立即用水冲洗,再用干燥布擦净,最后涂上NaHCO3溶液
错误,先用干燥布擦净,再用水冲洗,最后涂上NaHCO3溶液
7.一支25mL的滴定管中,液面所在刻度为12.00,则其中所盛液体体积大于13.00mL
正确
8.准确量取25.00mL的KMnO4溶液,可用50mL碱式滴定管
错误,应用酸式滴定管
9.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
正确
10.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口。分析下列实验温度计水银球位置。
(测定溶解度、制乙烯、硝基苯、苯磺酸、酚醛树脂、乙酸乙酯制备与水解、糖水解)测定溶解度(溶液)、制乙烯(反应液)、硝基苯(水浴)、苯磺酸(水浴)、酚醛树脂(沸水浴)、乙酸乙酯制备(直接加热)、水解(水浴)、糖水解(水浴)
11.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面下降的速度
错误,眼睛注视锥形瓶中指示剂颜色变化
12.称量时,称量物放在称量纸上,置于托盘天平的右盘,砝码放在托盘天平的左盘中
错误,左物右码
13.试管中注入某无色溶液密封,加热试管,溶液变红色,冷却后又变无色。确定溶液成分
应为SO2+品红溶液
14.只用一种试剂可以鉴别甲苯、氯仿、己烯、酒精、苯酚水溶液、纯碱溶液
正确,浓溴水
15.氢氧化钠溶液滴定醋酸时,通常选择甲基橙作指示剂,终点颜色由橙变黄
错误,通常选择酚酞作指示剂
16.除去蛋白质溶液中的可溶性盐可通过盐析的方法
错误,应该使用渗析
17.配制硫酸亚铁溶液所用的蒸馏水应预先煮沸,以除去溶解在水中的氧气
正确
18.试管、蒸发皿、坩埚、锥形瓶等仪器均可直接在酒精灯火焰上加热
错误,锥形瓶应当隔石棉网微热
19.饱和纯碱溶液可除去乙酸乙酯中的乙酸;渗析法分离油脂皂化所得的混合液
高考化学实验题知识点:化学公式实验常见公式
1、硫酸根离子的检验:BaCl2+Na2SO4=BaSO4↓+2NaCl
2、碳酸根离子的检验:CaCl2+Na2CO3=CaCO3↓+2NaCl
3、碳酸钠与盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑
4、木炭还原氧化铜:2CuO+C高温2Cu+CO2↑
5、铁片与硫酸铜溶液反应:Fe+CuSO4=FeSO4+Cu
6、氯化钙与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
7、钠在空气中燃烧:2Na+O2△Na2O2
钠与氧气反应:4Na+O2=2Na2O
8、过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑
9、过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2
10、钠与水反应:2Na+2H2O=2NaOH+H2↑
11、铁与水蒸气反应:3Fe+4H2O(g)=F3O4+4H2↑
12、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
13、氧化钙与水反应:CaO+H2O=Ca(OH)2
14、氧化铁与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O
15、氧化铝与盐酸反应:Al2O3+6HCl=2AlCl3+3H2O
16、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2O
17、氯化铁与氢氧化钠溶液反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl
18、硫酸亚铁与氢氧化钠溶液反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+O2=4Fe(OH)3
20、氢氧化铁加热分解:2Fe(OH)3△Fe2O3+3H2O↑
高考化学实验题知识点总结相关 文章 :
★ 高考化学实验题重要知识点总结
★ 高考化学实验题知识点
★ 高考化学实验探究题及答案
★ 高考化学实验题型答题技巧
★ 2017高考化学实验经典八大题
★ 高考复习化学实验题,2020年高考化学复习方法
★ 高三化学实验分析及试题考测
★ 高考化学电化学是最常见的实验题
★ 高考化学实验题知识大全
★ 高三化学专题训练探究实验题解题思路