您现在的位置是: 首页 > 教育资讯 教育资讯
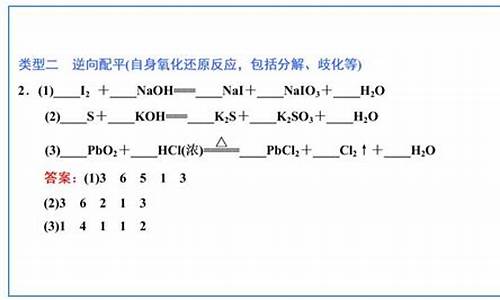
高考化学氧化还原反应配平,高考化学氧化还原
tamoadmin 2024-05-16 人已围观
简介乙烯 为有机反应中的加成反应,非氧化还原反应;氢氧化钾 是歧化反应,是氧化还原反应中的一种,方程式: 2KOH+Br2=KBr+KBrO+H2O2KOH+3Br2=KBr+KBrO3+H2OSO2 是氧化还原反应,方程式:SO2+Br2+2H2O=2HBr+H2SO4苯 是萃取,利用 Br2 在苯中的溶解度大于在水中的,非氧化还原反应;因为一个铬铁氧体分子中的铁
乙烯 为有机反应中的加成反应,非氧化还原反应;
氢氧化钾 是歧化反应,是氧化还原反应中的一种,方程式: 2KOH+Br2=KBr+KBrO+H2O
2KOH+3Br2=KBr+KBrO3+H2O
SO2 是氧化还原反应,方程式:SO2+Br2+2H2O=2HBr+H2SO4
苯 是萃取,利用 Br2 在苯中的溶解度大于在水中的,非氧化还原反应;
因为一个铬铁氧体分子中的铁元素数目大于铬元素,所以液体中的铁离子数目肯定大于铬离子浓度,反映后的溶液是盐溶液,不考虑水解,阴离子只和等于阳离子,所以反映后溶液中硝酸根浓度最大,则排名为c(NO3-)>c(Fe3+)>c(Cr3+),这是第一问。
第二问,根据题目的分子式,那其中的X只能取1,其他情况皆不符合,一个分子中不可能有半个铬离子,然后就可以得到分子式了,为Fe2+Fe3+[ Cr3+1· O4]。,可以看出,分子式中的铁元素数目为铬元素数目的2倍。然后,根据溶液电荷守恒定律,有3n(Fe3+)+3n(Cr3+)=n(NO3-),根据氮元素守恒,拿硝酸的量减去溢出气体的量2.688/22.4即为溶液中氮元素的量,也即1.92-0.12=1.8mol,为溶液中硝酸跟的浓度,那么根据电荷守恒式和n(Fe3+)=2(Cr3+),可以得到n(Cr3+)=0.2mol。一个铬铁氧体分子中分子中只有一个铬原子,他俩是一比一关系,那么消耗铬铁氧体的量就是0.2mol了。
第三问,这题的可以利用氧化还原知识来解,因为生成NO、NO2的反应为二价铁离子和硝酸的反应,分别写出两个反应的离子反映方程式,书上都有,然后蛇生成NO为Xmol,NO2为ymol,根据生成气体总量,可知x+y=2.688/22.4,然后根据反应式的对应关系,根据二价铁(等于消耗铬铁氧体的量)的含量为3x+y=0.2,联立方程解出得x = 0.04 y = 0.08,则x:y-1:2
完毕,不懂加我QQ问,931355130









